

Les glandes mammaires sont un "miroir", qui reflète indirectement tout l'état du corps de la femme. La morphologie de cet organe fait l'objet d'une attention particulière des médecins, car dans de nombreuses maladies, c'est au niveau de la poitrine qu'apparaissent les premiers changements. La Classification internationale des maladies de la 10e révision - CIM 10 regroupe les maladies des glandes mammaires sous le code n° 60-64. Il s'agit d'un groupe de pathologies différentes en termes de raisons et de mécanisme de développement, cryptées par des médecins avec des numéros spéciaux. Que signifient-ils, et comment ne pas se perdre dans le cryptage médical afin d'avoir toutes les informations sur sa santé ?
Les maladies des glandes mammaires de la CIM 10 (n ° 60-64) font l'objet d'une analyse statistique minutieuse. C'est l'une des raisons pour lesquelles la classification unifiée a été introduite. Selon les dernières données de l'Organisation mondiale de la santé, jusqu'à 40% des femmes souffrent de mastopathie parmi la population féminine du monde, et plus de la moitié de tous les cas (jusqu'à 58%) sont associés à des troubles gynécologiques. Il est particulièrement intéressant de noter que de nombreuses maladies du sein sont également des affections précancéreuses. L'incidence et le taux de mortalité par cancer du sein augmentent chaque année, malgré les énormes progrès de la médecine dans le domaine de leur diagnostic précoce et de leur traitement efficace. La part du lion des cas se produit dans les pays développés.

La classification internationalement acceptée de la CIM n ° 10 est également utilisée dans notre pays. Sur cette base, il y a :
· N 60 - Excroissances bénignes de la glande mammaire. La mastopathie appartient à ce groupe.
· N 61 - Processus inflammatoires. Parmi eux figurent l'anthrax, la mammite, l'abcès.
· N 62 - Agrandissement de la glande mammaire.
N 63 - Processus volumétriques dans la poitrine, sans précision (nœuds et nodules).
· N64 - Autres pathologies.
Chacune de ces maladies a ses propres causes, son tableau clinique caractéristique, ses méthodes de diagnostic et de traitement. Parlons-en maintenant.
La définition de la maladie remonte à 1984 par les experts de l'Organisation mondiale de la santé. Elle caractérise la dysplasie bénigne comme une combinaison de mécanismes pathologiques, se manifestant par des modifications à la fois régressives et progressives du tissu mammaire avec l'apparition de relations anormales entre l'épithélium et le tissu conjonctif. De plus, selon la définition, un signe important est la formation de changements dans le sein tels que la fibrose, les kystes et les proliférations. Mais ce n'est pas le principal symptôme pour poser un diagnostic, car. il n'est pas toujours disponible.
La maladie peut se manifester de diverses manières. Mais les principaux symptômes peuvent être distingués:
· Douleur sourde au niveau des glandes mammaires, qui a souvent tendance à augmenter avant le début des menstruations. Une fois les saignements menstruels passés, la douleur diminue généralement.
Irradiation - la propagation de la douleur à l'extérieur glande mammaire. Souvent, les patients se plaignent que la douleur est donnée à l'épaule, à l'omoplate ou au bras.
La présence d'éducation dans le sein ou le compactage de sa structure. Ce symptôme peut être déterminé par des patients attentifs à leur état de santé et palpant régulièrement.
La deuxième méthode est chirurgicale, qui est indiquée pour la forme nodulaire. La formation retirée est soumise à un examen histologique obligatoire pour exclure la présence de cellules cancéreuses atypiques. Le pronostic après traitement est favorable.
Les maladies du sein de la CIM-10 n ° 61 comprenaient: abcès, anthrax et mammite, qui est considérée comme la pathologie la plus courante dans ce groupe.
La mammite est une maladie inflammatoire. La défaite du sein est souvent unilatérale et ne s'étend que dans de rares cas (pas plus de 10%) aux deux glandes mammaires. La cause de la maladie est constituée de deux facteurs principaux qui se chevauchent:
Le premier est une violation de la sortie de lait;
La seconde est l'ajout de microflore pathogène ou conditionnellement pathogène.
Initialement, la maladie évolue selon le type d'inflammation aseptique (stérile). Cependant, très rapidement, littéralement en une journée, dans des conditions de stagnation de la sécrétion de lait et de température favorable, la microflore est activée. Ainsi commence le stade de l'inflammation bactérienne.
Le tableau clinique est presque le même chez toutes les femmes. Le premier symptôme est une forte élévation de la température à des valeurs élevées (38 - 39 ° C). De plus, une rougeur de la peau de l'une des glandes mammaires se joint, puis une douleur intense. Au fil du temps, ils ne font que se renforcer. Avec une inflammation sévère et l'absence de traitement rapide, la septicémie se développe très rapidement - une complication mortelle.
Le diagnostic est établi sur la base de données anamnestiques, objectives et de laboratoire. De l'anamnèse, il s'avère que la femme allaite. En règle générale, les risques augmentent si vous appliquez constamment l'enfant dans la même position. Dans ce cas, une vidange incomplète de la glande se produit. Un examen objectif montre une hyperémie de la glande enflammée, sa légère augmentation, ainsi qu'une douleur aiguë à la palpation. Une étude de laboratoire dans le sang révèle une hyperleucocytose avec des valeurs élevées.
Dans les premiers stades, un traitement conservateur (médicamenteux) est également efficace. La condition principale est l'expression complète du lait. À ces fins, un tire-lait n'est pas la meilleure solution, il est préférable de le faire à la main. La patiente peut effectuer la procédure par elle-même, mais souvent, en raison d'une douleur intense, il est nécessaire de faire appel à des personnes spécialement formées. Des médicaments ont recours à l'aide d'antibiotiques à large spectre. Habituellement, ces mesures sont suffisantes pour un rétablissement complet et un rétablissement ultérieur. allaitement maternel.
La plus grande erreur des patients est qu'ils ne prêtent pas attention aux changements de leur propre corps et ne vont pas chez les médecins, attribuant les maux aux déséquilibres hormonaux, au début d'un nouveau cycle ou à la proximité de la ménopause. Au fil du temps, la douleur prend un caractère douloureux constant. Avec une auto-palpation soigneuse, le patient peut détecter une formation dans la poitrine, ce qui sert souvent de raison de consulter un médecin.
Principales méthodes de recherche :
Collecte des réclamations
évaluation des données anamnestiques;
méthodes de recherche en laboratoire (test sanguin clinique général, analyse d'urine, test sanguin biochimique ou test de marqueur tumoral);
méthodes instrumentales (échographie, mammographie, biopsie).
Toutes les tumeurs mammaires font l'objet d'un traitement chirurgical. Après le retrait, le matériel biologique dans 100% des cas est envoyé pour un examen histologique, qui établit un diagnostic précis et la nécessité d'un traitement ultérieur.
Ce groupe comprend :
galactocèle - un kyste dans l'épaisseur de la glande mammaire, rempli de lait;
changement involutif après l'allaitement;
sécrétion du mamelon en dehors de la période de lactation;
Mamelon inversé
La mastodynie est une condition qui est perçue subjectivement. Elle se caractérise par une gêne au niveau de la poitrine. Ils peuvent être présents de manière continue ou intermittente.
Une place prioritaire dans les tactiques de travail des gynécologues et des oncologues est la propagande pour la prévention des maladies du sein. Il s'agit notamment de la publicité sociale, de diverses brochures médicales, de conversations préventives avec les patients à la réception, de l'augmentation de la popularité d'un mode de vie sain, ainsi que de l'approbation de la journée mondiale du cancer du sein.
Pour minimiser le risque de développer la maladie, ainsi que pour ne pas la manquer à un stade précoce, les règles suivantes doivent être suivies:
Refus de fumer et de boire de l'alcool;
traitement des maladies aiguës, ainsi que prolongation de la phase de rémission chronique;
passer des examens préventifs, en particulier après 35 ans;
Effectuer l'auto-palpation des glandes mammaires à la maison au moins une fois tous les 4 à 6 mois.

La dysplasie mammaire bénigne selon la CIM-10 ou mastopathie est une maladie des glandes mammaires (tumeur bénigne). Il apparaît à la suite de la croissance des tissus au cours de divers troubles hormonaux et il en existe 2 types : nodulaire (compactage unique) etmastopathie diffuse(avec plusieurs nœuds).La mastopathie survient principalement chez les femmes en âge de procréer. Ce phénomène est facile à expliquer. Chaque mois, dans un corps jeune, des changements périodiques se produisent sous l'influence des hormones œstrogène et progestérone, qui affectent non seulement le cycle menstruel, mais également le tissu mammaire (stimulation et inhibition de la division cellulaire, respectivement). Déséquilibre hormonal, provoquant un excès d'œstrogène, entraîne une prolifération tissulaire, c'est-à-dire à la mammite.De plus, la production intempestive de prolactine, l'hormone de la lactation, peut entraîner la maladie (elle apparaît normalement pendant la grossesse et l'allaitement).Le développement de la mastopathie peut provoquer une carence en vitamines, un traumatisme, un avortement, une prédisposition héréditaire, des maladies chroniques, etc.Vous pouvez sentir l'apparition de la mastopathie par vous-même. Il provoque des douleurs dans la glande mammaire, accompagnées d'une hypertrophie mammaire, d'un gonflement et d'une induration. Parfois, il peut y avoir un écoulement des mamelons. Si vous trouvez de tels signes, vous devez immédiatement contacter un spécialiste.
La mastopathie médicamenteuse est traitée avec des médicaments hormonaux (progestatifs, inhibiteurs d'œstrogènes, anti-œstrogènes, androgènes utilisés selon la classification internationale des maladies, CIM-10) et non hormonaux Mabusten.L'intervention chirurgicale est utilisée pour la mastopathie nodulaire et est diagnostiquée en deux types : la résection sectorielle (dans ce cas, la tumeur est retirée avec la région du sein) et l'énucléation (seule la tumeur est retirée). La chirurgie est indiquée en cas de suspicion de cancer du sein, la tumeur ou le kyste unique augmente rapidement.Le mode de vie affecte le prompt rétablissement. Pendant la période de traitement, il est préférable de limiter la consommation de thé et de café, d'inclure davantage de légumes et de fruits contenant des vitamines dans l'alimentation, d'abandonner les mauvaises habitudes, les procédures thermiques (par exemple, dans un bain ou un sauna) et de porter des sous-vêtements confortables . Diagnostique(mammologue) comporte plusieurs étapes :palpation des glandes mammaires en position couchée et debout, examen des mamelons, palpation des ganglions lymphatiques et de la glande thyroïde ;
Mammographie - radiographie des glandes mammaires;
. Échographie pour déterminer avec précision la structure et l'emplacement du néoplasme dans le sein;
. biopsie - examen des tissus pour les oncogènes;
. études hormonales, examen du foie et consultation de spécialistes (gynécologue, oncologue).
Nous accueillons tous les lecteurs sur le site qui souhaitent en savoir plus sur ce qu'est la mastopathie et sur les types que cette maladie peut prendre. La conversation d'aujourd'hui est consacrée à l'examen des signes de pathologie, de ses types et éléments de thérapie.
Le code de la mastopathie pour la CIM-10 a récemment "changé". Elle fait aujourd'hui partie du groupe N60 (dysplasie bénigne). Cela seul permet de comprendre que la pathologie est bénigne. Poussant un soupir de soulagement, regardons la maladie "au microscope", c'est-à-dire plus en détail.
Il a un autre nom - la maladie fibrokystique. Ce n'est pas une maladie, mais plusieurs pathologies des glandes mammaires associées à des modifications des tissus glandulaires. La base des changements est la violation de la relation entre le tissu conjonctif et les éléments épithéliaux.
La probabilité de développer cette maladie est maximale à l'âge de 40-45 ans, au moment des changements hormonaux dans le corps, préparant l'arrêt des fonctions de procréation.
La version la plus connue de la classification de la maladie identifie trois sous-groupes de conditions pathologiques :
La mastodynie est caractérisée par un syndrome douloureux sévère. Avec de telles manifestations de la pathologie, les médicaments analgésiques sont indiqués.
La forme diffuse de la fibroadénomatose est la croissance de formations diffuses et de kystes. Il se présente sous 4 formes :
 Une forme localisée ou nodulaire de fibroadénomatose se caractérise par l'apparition d'un néoplasme dans un segment séparé de la glande. La tumeur ne s'étend pas à tout le volume du tissu glandulaire. Si des signes d'adénomatose localisée sont trouvés, une biopsie est recommandée. L'échantillonnage du matériel est nécessaire pour exclure le cancer.
Une forme localisée ou nodulaire de fibroadénomatose se caractérise par l'apparition d'un néoplasme dans un segment séparé de la glande. La tumeur ne s'étend pas à tout le volume du tissu glandulaire. Si des signes d'adénomatose localisée sont trouvés, une biopsie est recommandée. L'échantillonnage du matériel est nécessaire pour exclure le cancer.
Le principal symptôme de la maladie est l'apparition de formations denses dans glande mammaire:
De telles formations peuvent être indolores, légèrement douloureuses avec une douleur accrue pendant la menstruation, douloureuses avec une douleur intense pendant la menstruation. Les symptômes typiques de la maladie fibrokystique sont :
Avec la prédominance des changements fibrotiques dans les tissus mammaires, les formations denses sont clairement palpables. Si l'avantage s'avère être du côté des kystes, la palpation peut donner un résultat négatif (les kystes ne sont pas palpables). Des examens complémentaires seront nécessaires. 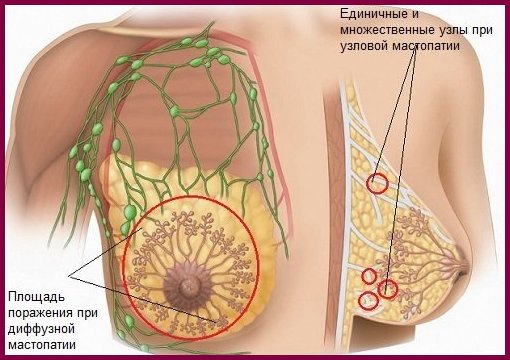
Vraisemblablement, le rôle principal dans le développement de la maladie est attribué à un excès d'œstrogène et de carence en progestérone. Les facteurs supplémentaires dans le développement de la maladie chez les femmes adultes sont:
La dysharmonie de l'état mental et de la vie sexuelle est le principal mécanisme moteur qui déclenche le développement de signes de mastopathie chez la femme après 30 ans. Les jeunes filles se familiarisent rarement avec cette maladie.
Les 4 derniers facteurs provoquent le plus souvent le développement de la maladie fibrokystique chez les enfants.
Chez les enfants de la première année de vie, une mastopathie adaptative est possible. C'est la première crise hormonale du bébé. La condition n'est pas considérée comme une pathologie, survient chez les enfants des deux sexes, passe sans traitement médical. 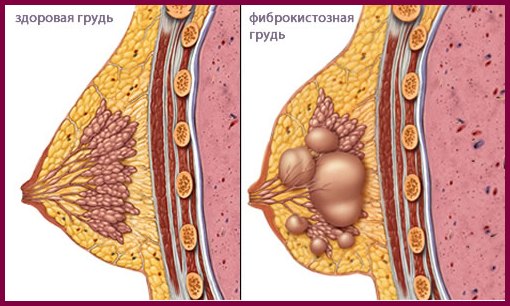
En médecine, un phénomène similaire chez les filles est appelé synkaïnogénèse ou "petite puberté". Les symptômes de cette condition sont :
Si votre fille a une petite puberté, elle n'a pas besoin de traitement. Mais juste au cas où, pour exclure la pathologie, montrez l'enfant au pédiatre.
Si les signes de mastopathie persistent après un an, l'enfant doit être présenté à un spécialiste. Au bout de 3 ans, on parle clairement d'une pathologie qui nécessite une intervention médicale.
Le traitement de la maladie peut être conservateur ou chirurgical. Les mesures spécifiques dépendent des causes identifiées de la maladie. En cas d'excès d'œstrogènes et de fortes douleurs mammaires, des médicaments peuvent être prescrits pour réduire la sensibilité à cette hormone des tissus glandulaires (tamoxifène). 
Avec les affections endocriniennes et les pathologies des organes internes, le traitement vise principalement à restaurer les fonctions corporelles altérées. Dans le traitement de cette maladie, les remèdes à base de plantes et les préparations homéopathiques ont fait leurs preuves. Dans certains cas, des préparations de progestérone peuvent être utilisées.
Pour le traitement des formations nodulaires uniques, la chirurgie ou l'ablation au laser est utilisée.
Sur ce, nous vous disons au revoir. Partagez les informations qui vous intéressent avec vos amis et visitez à nouveau notre site.
Substances actives pour le traitement de N64 Autres maladies de la glande mammaire
C 32 H 40 BrN 5 O 5
Stimulateur des récepteurs dopaminergiques centraux et périphériques D2, un dérivé alcaloïde de l'ergot de seigle. Stimule les récepteurs de la dopamine D 2 dans le cerveau. Inhibe l'incrétion de prolactine et supprime la lactation physiologique, normalise la fonction menstruelle; faciliter la transmission dopaminergique dans le système nigro-strié, réduit la sévérité des symptômes du parkinsonisme ; réduit la concentration de somatotropine dans le sang...
Gestagen. Hormone du corps jaune. Provoque la transition de la muqueuse utérine de la phase de prolifération provoquée par l'hormone folliculaire à la phase de sécrétion et, après la fécondation, contribue à sa transition vers l'état nécessaire au développement d'un ovule fécondé. Réduit l'excitabilité et la contractilité des muscles de l'utérus et des trompes de Fallope, stimule...
Progestatif synthétique. Provoque le passage de l'endomètre de la phase de prolifération à la phase de sécrétion. Supprime l'ovulation. Le mécanisme d'action contraceptive est principalement associé à l'effet gestagène périphérique sur le système reproducteur, qui se traduit par une diminution de la quantité et une augmentation de la viscosité du mucus cervical, une diminution de la capacité de pénétration des spermatozoïdes. Opprime les transports...
Gestagen. Provoque la transformation de la muqueuse utérine de la phase de prolifération à la phase de sécrétion et, après la fécondation, contribue à sa transition vers un état favorable au développement d'un ovule fécondé. Il a de légères propriétés œstrogéniques et androgènes. Réduit l'excitabilité et la contractilité des muscles de l'utérus, stimule le développement des extrémités...
Vitamine D2, régulateur du métabolisme du calcium et du phosphore. Augmente la perméabilité de l'épithélium intestinal pour le calcium et le phosphore, en fournit les concentrations nécessaires dans le sang. Régule la minéralisation du tissu osseux, ainsi que le processus de mobilisation du calcium à partir du tissu osseux. Favorise la réabsorption du phosphate dans les tubules rénaux. Il cumule...
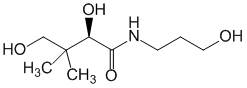
Compense la carence en acide pantothénique, a un effet anti-inflammatoire, stimule les processus de régénération. Dans l'organisme, il forme un métabolite actif - l'acide pantothénique, qui est un substrat (le seul composant indispensable) stimulateur de la synthèse de la coenzyme A ; ce dernier catalyse l'acylation dans l'organisme, participe à presque tous les processus métaboliques (cycle de l'acide tricarboxylique, métabolisme...
Moyen d'origine végétale, a un effet anti-inflammatoire, stimule la régénération des tissus épithéliaux.
Lorsqu'il est appliqué par voie orale, il a un effet protecteur dans les lésions ulcéreuses de la membrane muqueuse de l'estomac et des intestins causées par des substances ulcérogènes avec divers mécanismes d'action néfaste.
Lorsqu'il est appliqué à l'extérieur, il aide à nettoyer les plaies des écoulements purulents, accélère...
Agent antimicrobien à usage externe. C'est un antibiotique produit par le champignon rayonnant Actinomyces flavochromogenes var. héliomycines. Actif contre Gram-positif et certains autres micro-organismes. ...
 Cette composante du syndrome hyperplasique comprend un large éventail de modifications pathologiques des tissus épithéliaux, stromaux et autres (modifications des adipocytes, des structures vasculaires) dans les glandes mammaires, combinées concept général"Fibroadénomatose" ou "mastopathie". Il convient de noter que la classification et l'analyse de ce type de SH (syndrome hyperplasique) est très difficile et controversée en raison du manque de critères cliniques et morphologiques clairs pour distinguer les changements physiologiques et pathologiques des glandes mammaires. Cela conduit à de nombreuses conclusions contradictoires sur un lien possible entre les modifications bénignes des glandes mammaires et le développement ultérieur de néoplasmes malins dans celles-ci.
Cette composante du syndrome hyperplasique comprend un large éventail de modifications pathologiques des tissus épithéliaux, stromaux et autres (modifications des adipocytes, des structures vasculaires) dans les glandes mammaires, combinées concept général"Fibroadénomatose" ou "mastopathie". Il convient de noter que la classification et l'analyse de ce type de SH (syndrome hyperplasique) est très difficile et controversée en raison du manque de critères cliniques et morphologiques clairs pour distinguer les changements physiologiques et pathologiques des glandes mammaires. Cela conduit à de nombreuses conclusions contradictoires sur un lien possible entre les modifications bénignes des glandes mammaires et le développement ultérieur de néoplasmes malins dans celles-ci.
Les premières tentatives de classification des modifications hyperplasiques des glandes mammaires étaient basées sur des signes purement cliniques, lorsque les formations palpables étaient divisées en formes diffuses (mastopathie) et nodulaires (nodose) - adénome, fibroadénome. Selon la définition de l'HS par rapport aux glandes mammaires, adoptée par l'OMS (1984), la mastopathie est une maladie caractérisée par un large éventail de modifications prolifératives et régressives des tissus mammaires avec un rapport perturbé des composants épithéliaux et conjonctifs.
Conformément à la Classification statistique internationale des maladies de la dernière révision (CIM-10), plusieurs variantes de la maladie ont été identifiées, qui sont présentées dans le tableau. 4.3.
Tableau 4.3
Classification de la dysplasie bénigne des glandes mammaires (selon la CIM-10)
Il convient de noter que des données statistiques précises sur l'incidence de la FAM (fibroadénomatose) ne sont pas disponibles en raison de l'absence de critères de diagnostic uniformes et d'une classification pathogénique claire de la maladie. Dans le même temps, une estimation très approximative de la fréquence des FAM (fibroadénomatose) des glandes mammaires indique une propagation importante de la maladie. Ainsi, on pense que pendant la période préménopausique, la fibroadénomatose survient dans environ 70% de toutes les maladies bénignes du sein. Des taux d'incidence peut-être plus précis sont reflétés dans les études de cohorte dans lesquelles le taux d'incidence cumulé de FAM (diagnostics confirmés par biopsie) à 65 ans était de 8,8 % et pour le fibroadénome était de 2,2 %.
Les changements morphologiques observés dans les glandes mammaires chez les patients atteints de fibroadénomatose sont caractérisés par les caractéristiques suivantes (Semiglazov V.F. et al., 1992):
1) hyperplasie de la muqueuse épithéliale des canaux et des lobules de la glande mammaire (adénose ou mazoplasie). Il y a une augmentation du nombre et de la taille des lobules de la glande mammaire ;
2) fibrose du tissu conjonctif interlobulaire. Se manifeste par une augmentation du nombre de fibres de collagène et une diminution du nombre de cellules du tissu conjonctif;
4) la prolifération des cellules épithéliales, qui peut être observée dans les conduits, les lobules et les kystes.
Tous ces changements peuvent être déterminés isolément ou combinés dans des proportions différentes, se développer dans des zones limitées des glandes mammaires ou avoir un développement multifocal.
L'évaluation de la sévérité des modifications prolifératives de l'épithélium dans les canaux et les lobules de la glande est d'une importance primordiale pour déterminer le pronostic et l'ampleur du risque relatif de développer un cancer du sein. A cet égard, trois formes de FAM sont distinguées sur la base d'une étude morphologique du matériel de biopsie :
1) forme non proliférative ;
2) forme proliférative, sans atypie ;
3) prolifération atypique intracanalaire.
Compte tenu de cette classification, le plus grand risque de développer un cancer du sein est observé dans les groupes de femmes qui présentent des signes de prolifération atypique dans le sein.
La forme non proliférative la plus courante de FAM, qui ne se caractérise pas par la croissance de l'épithélium des lobules et des canaux. Le risque relatif de développer un cancer du sein pour ce groupe de femmes ne dépasse pas celui de la population générale. La forme proliférative de FAM, et en particulier la forme proliférative avec prolifération atypique, augmente de 3 à 5 fois le risque de développer une tumeur maligne.
Une régularité est également notée dans la dynamique par âge des changements de FAM. Chez les filles, lors de la formation de la fonction menstruelle, des fibroadénomes immatures surviennent souvent; dans la période de reproduction mature (25 à 39 ans), une FAM diffuse bilatérale se développe de plus en plus. Pendant la période de périménopause et avec le début de la postménopause (40–49 ans), le développement de formes localisées de FAM, de FAM kystique et d'adénose sclérosante est caractéristique. Avec le début de la postménopause profonde, la fréquence des processus prolifératifs et des diverses formes de mastopathie diminue fortement et les processus non prolifératifs (ductectasie, galactophorite, involution graisseuse) prennent le dessus. Mais dans la même période, l'incidence du cancer du sein augmente fortement (Semiglazov VF et al., 1992).
L'évolution notée liée à l'âge des modifications bénignes des glandes mammaires est sans aucun doute déterminée par la dynamique liée à l'âge de la sécrétion d'hormones sexuelles. Le pic de sécrétion d'hormones sexuelles, qui tombe sur toute la période de reproduction, stimule la prolifération des tissus cibles, tandis que l'extinction de la fonction ovarienne détermine la diminution du fond hormonal (principalement les œstrogènes) et le développement de changements involutifs dans l'ensemble de la reproduction. système.
La dysplasie mammaire bénigne (DMO) est un ensemble de processus caractérisés par un large éventail de changements prolifératifs et régressifs dans les tissus mammaires avec la formation de rapports anormaux de composants épithéliaux et conjonctifs et la formation de changements fibreux, kystiques et prolifératifs dans la glande mammaire. , qui souvent, mais pas nécessairement, coexistent (définition OMS, 1984).
Maladie fibrokystique, mastopathie fibrokystique.
CIM-10 CODE
Maladies de la glande mammaire (N60-N64)
À l'exclusion de : maladie mammaire associée à la grossesse (O91–O92).
N60 Dysplasie bénigne de la glande mammaire.
Comprend : mastopathie fibrokystique
N60.0 Kyste solitaire de la glande mammaire.
Kyste mammaire.
N60.1 Mastopathie kystique diffuse
Glande mammaire kystique.
À l'exclusion de : avec prolifération de l'épithélium (N60.3).
N60.2 Fibrodénose de la glande mammaire.
À l'exclusion de : fibroadénome du sein (D24).
N60.3 Fibrosclérose de la glande mammaire.
Mastopathie kystique avec prolifération de l'épithélium.
N60.4 Ectasie des canaux mammaires.
N60.8 Autres dysplasies bénignes de la glande mammaire
N60.9 Dysplasie bénigne de la glande mammaire, sans précision
N61 Maladies inflammatoires de la glande mammaire.
À l'exclusion de : mammite infectieuse du nouveau-né (P39.0).
N62 Hypertrophie de la glande mammaire.
N63 Masse dans la glande mammaire, sans précision.
N64 Autres maladies de la glande mammaire.
N64.0 Fissure et fistule du mamelon.
N64.1 Nécrose graisseuse de la glande mammaire.
N64.2 Atrophie de la glande mammaire.
N64.3 Galactorrhée non associée à la procréation
N64.4 Mastodynie.
N64.5 Autres signes et symptômes mammaires
N64.8 Autres maladies précisées du sein
N64.9 Maladie de la glande mammaire, sans précision
Le DMDM est l'une des maladies les plus courantes chez les femmes : dans la population, l'incidence est de 30 à 40 %, et chez les femmes souffrant de diverses maladies gynécologiques, elle est de 58 %. La fréquence de la mastopathie atteint un maximum à l'âge de 45 ans et diminue à l'âge préménopausique.
L'incidence du cancer du sein dans le monde est en constante augmentation, alors que dans les pays occidentaux à niveau de vie élevé, l'incidence de cette maladie est environ 5 fois plus élevée que dans les pays asiatiques. Cette différence est particulièrement vraie pour les femmes ménopausées. Dans les populations occidentales, on observe une augmentation constante de l'incidence du cancer du sein avec l'âge, alors que dans les pays asiatiques, l'incidence du cancer du sein augmente à 50 ans, puis diminue légèrement ou reste inchangée.
Actuellement, les approches de prévention du cancer du sein comprennent un diagnostic précoce par mammographie de dépistage, ainsi qu'une modification du mode de vie (diminution de l'alimentation faible en gras et augmentation des fibres alimentaires dans l'alimentation, augmentation de l'activité physique). Il a été démontré qu'un régime pauvre en graisses et une activité physique régulière réduisent la graisse du ventre et augmentent la sensibilité à l'insuline, et donc préviennent le diabète de type 2. À la suite de la perte de poids, on observe une diminution de la concentration d'œstrogène chez les femmes pré- et post-ménopausées, ce qui réduit finalement le risque de développer un DMDM post-ménopausique et un cancer du sein.
Un mode de vie sain prévient également l'obésité chez les enfants et les adolescents en prévenant l'apparition précoce des règles, réduisant ainsi le risque de cancer du sein chez les jeunes femmes d'âge moyen (avant la ménopause).
La détection rapide des maladies endocriniennes et leur correction adéquate réduisent l'incidence du DMDM de 50%.
Manquant actuellement.
De nombreuses classifications des maladies fibrokystiques des glandes mammaires ont été proposées. Cependant, aucun d'entre eux ne reflète pleinement toute la variété des changements morphologiques dans les tissus des glandes mammaires. La classification la plus répandue était N.I. Rozhkova (1993), qui distingue les formes suivantes de mastopathie, qui peuvent être notées sur les radiographies et l'examen morphologique :
Dans la forme non proliférative, des zones de tissu fibreux sont associées à des cavités kystiques, tandis que des modifications pathologiques se développent au sein de l'unité canalo-lobulaire et que des kystes se forment lors de la dilatation de petits canaux (ductules - alvéoles). Les kystes sont tapissés par un "épithélium de revêtement" - un épithélium atrophique ou un épithélium qui a subi une apocrinisation. Parfois, le processus de fibrose prévaut et des nœuds ressemblant à des tumeurs se forment, principalement en raison d'une augmentation du tissu fibreux hyalinisé acellulaire entourant les lobules et les canaux atrophiques - fibrose focale.
Dans la forme proliférative de la mastopathie, on distingue les variantes épithéliales, myoépithéliales et fibroépithéliales de la prolifération. Le degré de risque de développer un cancer du sein augmente avec l'apparition et le développement de kystes et dépend de la gravité de la prolifération de l'épithélium canalaire intralobulaire, ainsi que de «l'épithélium de revêtement» des kystes.
Il existe une classification basée sur la division de la mastopathie selon la sévérité de la prolifération :
I degré - mastopathie fibrokystique sans prolifération;
Degré II - mastopathie fibrokystique avec prolifération épithéliale sans atypie;
Degré III - mastopathie avec prolifération atypique de l'épithélium.
De plus, les degrés II et III sont appelés états précancéreux. Selon K. Prechtel et al., (1979), la mastopathie du degré I représente 70%, le degré II - 21% et le degré III - 5% des cas.
Il existe une opinion selon laquelle la forme non proliférative de DMDM pourrait également jouer un rôle dans la carcinogenèse mammaire. Un certain nombre d'auteurs décrivent la métaplasie muqueuse de l'épithélium des kystes et accordent une attention particulière à ce type de métaplasie comme facteur augmentant le risque de développer un cancer.
Le risque de malignité dans la forme non proliférative est de 0,86%, avec une prolifération modérée - 2,34%, avec une prolifération prononcée - 31,4%. Selon des études histologiques du matériel chirurgical, le cancer du sein est associé au DMDM dans 46% des cas.
Facteurs de risque de développer le DMDM :
Le parenchyme est soumis à l'influence hormonale, qui est directement affectée par les œstrogènes, la progestérone, la prolactine et l'hormone somatotrope en dehors de la grossesse, pendant la grossesse - œstrogènes placentaires, progestérone, lactogène et prolactine. Les hormones thyroïdiennes et l'insuline agissent indirectement sur le tissu mammaire.
Dans une moindre mesure, le stroma est soumis à des effets hormonaux, dans lesquels une hyperplasie est possible sous l'influence des œstrogènes. La relation entre les hormones et le tissu adipeux de la glande mammaire n'est pas bien comprise. Le tissu adipeux, les adipocytes de la glande mammaire sont des dépôts d'œstrogènes, de progestérone et d'androgènes. Les adipocytes ne synthétisent pas les hormones sexuelles, mais les capturent activement à partir du plasma. Sous l'influence des aromatases, les androgènes sont convertis en estradiol et en estrone.
Ce processus augmente avec l'âge, ce qui peut être l'un des facteurs qui augmentent le risque de développer un cancer du sein.
Une cause importante de maladies dysplasiques des glandes mammaires est considérée comme un déséquilibre des stéroïdes sexuels - œstrogènes et progestérone dans le corps d'une femme, à la suite de quoi un hyperestrogénisme relatif se développe, ce qui conduit à la prolifération de l'épithélium des alvéoles, des conduits , augmente l'activité des fibroblastes et provoque la prolifération du tissu conjonctif de la glande mammaire.
L'énorme influence des œstrogènes sur le tissu des glandes mammaires ne fait aucun doute. Pour donner quelques exemples : l'ovariectomie bilatérale chez les femmes de moins de 35 ans réduit de 75 % le risque de développer un cancer du sein ; l'utilisation d'anti-œstrogènes (tamoxifène) réduit de 50 % le risque de développer un cancer du sein.
Actuellement, trois mécanismes équivalents et non mutuellement exclusifs de l'effet prolifératif des œstrogènes sur la glande mammaire sont supposés :
1) stimulation directe de la prolifération cellulaire due à l'interaction de l'estradiol associé au récepteur des œstrogènes avec l'ADN nucléaire ;
2) un mécanisme indirect - dû à l'induction de la synthèse de facteurs de croissance agissant sur l'épithélium de la glande mammaire auto ou paracrine ;
3) stimulation de la croissance cellulaire due à une rétroaction négative, selon laquelle les œstrogènes neutralisent les effets des facteurs de croissance inhibiteurs.
L'effet des œstrogènes sur la prolifération cellulaire dans les tissus mammaires peut également être médié par des facteurs de croissance. Les facteurs de croissance et proto-oncogènes suivants stimulent la prolifération et la différenciation des cellules épithéliales de la glande mammaire et inhibent l'apoptose : facteur de croissance épidermique (EGF) ; les facteurs de croissance analogues à l'insuline de types I et II (IPFRI et IPFRII); facteur de croissance transformant α (TGFα) et proto-oncogènes.
Il existe également une théorie de l'effet génotoxique des œstrogènes, selon laquelle les métabolites de l'œstradiol sont le 4OH E2 ; 3,4quinone - pénètre dans la cellule, contourne les récepteurs des œstrogènes, se lie à l'ADN nucléaire, l'endommageant.
La progestérone est capable de limiter l'effet des œstrogènes sur le tissu mammaire. Selon la dose et la durée d'exposition, la progestérone peut potentiellement modifier la réponse des cellules mammaires normales et cancéreuses à différents niveaux :
Ainsi, avec la capacité de la progestérone à réduire l'expression des récepteurs aux œstrogènes, cette hormone réduit la concentration locale d'œstrogènes actifs, limitant ainsi la stimulation de la prolifération du tissu mammaire.
Comme les œstrogènes, la progestérone affecte également indirectement la prolifération cellulaire de l'épithélium de la glande mammaire par le biais de facteurs de croissance. Ainsi, la progestérone augmente l'expression du TGFα (transforming growth factor) et de l'EGF (epidermal growth factor) et diminue l'expression du TGFβ et de l'IPFII (insulin-like growth factor). Les facteurs ci-dessus sont principalement produits par le stroma de la glande mammaire sous l'influence de la progestérone.
Il a été établi que l'EGF, le TGFα et l'IPFR-I provoquent la prolifération épithéliale, tandis que le TGFβ l'inhibe. Les facteurs de croissance montrent leurs effets tardivement, et non immédiatement après l'exposition à la progestérone, et il existe des interactions entre les facteurs de croissance eux-mêmes, se manifestant par des modifications de leur expression et de leur connexion avec les récepteurs.
En agissant différemment sur la prolifération, les facteurs de croissance induits par la progestérone sont susceptibles de provoquer des effets opposés de la progestérone sur les tissus. Il a été noté que la surexpression des facteurs de croissance peut se manifester par une augmentation transitoire de la prolifération suivie de son inhibition.
L'effet ambigu de la progestérone sur le tissu mammaire est également associé à l'effet de ce dernier sur divers types de récepteurs de la progestérone, qui sont de deux types : A et B. Bien que les deux types de récepteurs se lient à la progestérone, leur activité fonctionnelle est différente. Alors que le type B du récepteur fournit les effets de la progestérone sur la cellule, le type A supprime son activité. Dans divers tissus cibles de la progestérone, le rapport des différents types de récepteurs peut déterminer la sensibilité de ces tissus à l'action de cette hormone. Comme il a été constaté, le rapport des deux types de récepteurs est normalement égal, cependant, avec le développement de processus dysplasiques dans la glande mammaire, l'un des types de récepteurs commence à prédominer dans ses tissus, assurant ainsi la sensibilité du glande mammaire aux effets de la progestérone, et le rapport des deux types de récepteurs varie selon les patients.
On sait que le développement de processus hyperplasiques dans les glandes mammaires est observé chez 52% des patients atteints d'hyperprolactinémie. Le rôle pathogénique de l'hyperprolactinémie dans le développement de la mastopathie n'a pas été entièrement élucidé.
Peut-être, d'une part, une augmentation de la teneur en prolactine dans le sérum sanguin ne peut-elle être qu'un marqueur de troubles centraux (hypothalamo-hypophysaire) du système de régulation de la fonction de reproduction. Mais, d'autre part, un excès de prolactine a un effet stimulant direct sur les processus prolifératifs dans les organes cibles périphériques du système reproducteur, réalisé en augmentant le contenu des récepteurs d'estradiol dans les tissus mammaires et en augmentant la sensibilité des cellules à l'action du dernier. Cependant, le rôle de l'hyperprolactinémie comme facteur de risque du cancer du sein n'a pas été prouvé.
La question du rôle de l'hypothyroïdie dans le développement du cancer du sein n'a pas non plus été étudiée. Cependant, il a été prouvé qu'un hypofonctionnement de la glande thyroïde augmente le risque de dysplasie mammaire de 3,8 fois par rapport aux femmes en bonne santé. La plupart des patients atteints d'hypothyroïdie présentent une insuffisance de la phase lutéale du cycle ou des cycles anovulatoires, ainsi qu'une stimulation accrue des lactotrophes hypophysaires par la thyrolibérine et, par conséquent, une hyperprolactinémie fonctionnelle se produit, ce qui peut finalement conduire au développement de processus prolifératifs dans les tissus. des glandes mammaires.
La résistance à l'insuline existante dans le diabète sucré de type 2 et l'obésité s'accompagne d'une hyperinsulinémie compensatoire chronique. De nombreuses études cas-témoins ont montré que l'hyperinsulinémie à long terme augmente le risque de cancer du sein.
Des études prospectives récentes montrent que les facteurs de risque de cancer du sein chez les femmes ménopausées comprennent également une augmentation des concentrations d'hormones stéroïdes sexuelles (œstradiol et testostérone libres, œstrone, déhydroépiandrostérone (DEA) et sulfate de DEA, androstènedione) et une diminution de la globuline liant les stéroïdes sexuels, souvent associée avec surpoids (obésité abdominale) et hyperinsulinémie.
Il a été suggéré que la carcinogenèse dans les glandes mammaires puisse être initiée chez les femmes obèses en raison des effets synergiques de l'hyperinsulinémie et des concentrations élevées d'œstrogènes résultant de la réaction d'aromatisation des androgènes (provenant des glandes surrénales post-ménopausiques) dans le tissu adipeux en œstrogènes. Ces influences peuvent stimuler l'activité moléculaire et biochimique locale des cellules, conduisant à l'émergence d'une activité invasive dans les tissus mammaires altérés de manière prénéoplasique.
Depuis 1990, plusieurs études prospectives ont révélé un risque accru de cancer du sein chez les femmes ménopausées présentant des taux élevés d'œstrogènes. Un certain nombre d'études examinant l'effet de concentrations élevées d'androgènes sur le risque de cancer du sein ont également montré une corrélation positive, et selon 4 d'entre elles, cette relation était indépendante de la concentration d'œstrogènes formés à la suite de la conversion des androgènes dans le tissu adipeux. Ainsi, une augmentation des concentrations de stéroïdes sexuels (œstrogènes et androgènes) augmente le risque de développer un cancer du sein chez les femmes ménopausées. Des concentrations élevées d'estradiol libre et de testostérone chez les femmes pré- et postménopausées sont presque toujours associées à une augmentation de la graisse abdominale, dans laquelle les changements hormonaux sont probablement associés à une augmentation des concentrations de triglycérides et d'insuline et à une diminution de la globuline liant les stéroïdes sexuels. L'obésité abdominale est presque toujours associée à une résistance à l'insuline et à une hyperinsulinémie compensatoire. Dans les pays occidentaux, la résistance à l'insuline prédomine chez les femmes de plus de 35 ans et est régulée par des rétroactions positives avec prise de poids, apport calorique élevé et faible activité physique.
Ainsi, des études interculturelles suggèrent que l'incidence accrue du cancer du sein dans les pays occidentaux développés pourrait être associée à une prévalence élevée d'obésité et de diabète de type 2. Une teneur élevée en graisse abdominale, une résistance à l'insuline et une hyperinsulinémie, une augmentation de la concentration en facteur de croissance analogue à l'insuline sont des marqueurs d'un risque élevé de cancer du sein. Des concentrations élevées d'estradiol libre et de testostérone libre sont également des facteurs de risque de cancer du sein et sont souvent associées à l'obésité et à l'hyperinsulinémie.
La pathogenèse des processus de carcinogenèse dans la glande mammaire dans ces troubles métaboliques et endocriniens n'est pas complètement claire, cependant, ces mécanismes prévalent à l'âge postménopausique, lorsque l'obésité et diabète Le type 2 est très répandu chez les femmes des pays occidentaux et est étroitement associé au soi-disant "mode de vie occidental".
Le tissu adipeux est une source d'acides gras libres, le facteur de nécrose tumorale α, qui sont impliqués dans la pathogenèse de la résistance à l'insuline dans l'obésité.
La résistance à l'insuline et l'hyperinsulinémie compensatoire activent l'activité proliférative et invasive dans les tissus de la glande mammaire prénéoplasique altérés (en particulier dans les cellules du carcinome canalaire in situ), ce qui augmente considérablement le risque de progression vers un cancer du sein invasif, qui se manifeste cliniquement, en règle générale, chez les femmes ménopausées.
Bien que, selon de nombreuses études épidémiologiques, les femmes jeunes et d'âge moyen atteintes de diabète de type 2 ne soient pas à risque de développer un cancer du sein, et chez les femmes du même âge ayant un indice de masse corporelle élevé, il y a même une légère diminution de l'incidence du cancer du sein à l'âge précédant la ménopause, cependant, des études scientifiques récentes ont montré que l'obésité et le diabète de type 2 dans ce groupe d'âge augmentent le risque de cancer du sein post-ménopausique.
Dans le diabète de type 1, le mécanisme de formation de la mastopathie est complètement différent. Avec une hyperglycémie à long terme dans les glandes mammaires, dans 70% des cas, la mastopathie dite "diabétique" (lobulite lymphocytaire sclérotique), qui a une nature auto-immune, se développe. L'hyperglycémie entraîne une accumulation extracellulaire de produits de glycosylation non enzymatique de protéines aux propriétés néoantigéniques, ce qui provoque le lancement de processus auto-immuns et, par conséquent, une infiltration de cellules lymphoïdes périvasculaires, la sclérose stromale, qui est le principal substrat morphologique de la mastopathie "diabétique". .
Le statut hormonal insuffisamment étudié chez les patients atteints de dysplasie proliférative des glandes mammaires rend difficile l'explication du mécanisme spécifique conduisant au développement de processus dysplasiques dans les glandes mammaires et, par conséquent, le choix des méthodes de correction de ces changements.
Avec l'une des maladies endocriniennes les plus courantes des organes génitaux - le syndrome des ovaires polykystiques (SOPK) - le DMDM survient chez un patient sur deux. Deux raisons expliquent la survenue de DMDM dans le syndrome des ovaires polykystiques : d'une part, le déficit en progestérone caractéristique de cette maladie exacerbe les processus de prolifération au niveau de la glande mammaire ; d'autre part, avec la résistance à l'insuline chez les patientes atteintes du syndrome des ovaires polykystiques, l'effet indirect de l'insuline sur les cellules mammaires par le biais de facteurs de croissance analogues à l'insuline est également important. De plus, il faut noter l'action du cortisol qui favorise la formation des récepteurs de la prolactine dans les glandes mammaires et stimule la croissance des cellules épithéliales en synergie avec la prolactine.
Les œstrogènes provoquent la prolifération de l'épithélium des alvéoles, du tissu conjonctif de la glande, des conduits et augmentent l'activité des fibroblastes. La morbidité gynécologique des femmes atteintes de mastopathie est de 115 %, soit 1,1 maladies par patient. Le plus souvent, la mastopathie est associée à des processus hyperplasiques dans les organes du système reproducteur: hyperplasie de l'endomètre, adénomyose, fibromes utérins. Cela témoigne du caractère commun de la pathogenèse des maladies de tous les organes de la reproduction et justifie la thérapie pathogénique, qui devrait être effectuée par un gynécologue pour tous les patients atteints de maladies bénignes des glandes mammaires sans exception.
La principale plainte des patientes atteintes de mastopathie est la douleur, généralement aggravée pendant la période prémenstruelle, commençant parfois à partir de la seconde moitié du cycle menstruel. La douleur peut être localisée et irradier vers le bras ou l'omoplate. Moins souvent, les patients se tournent vers moi au sujet de la décharge du mamelon.
En systématisant la douleur, on distingue 3 groupes de douleur :
Établissement des facteurs de risque possibles pour le DMDM et le cancer du sein :
La principale méthode est la palpation des glandes mammaires et des zones régionales de drainage lymphatique. Avant de procéder à l'étude des glandes mammaires chez les femmes en âge de procréer, il est nécessaire de clarifier la phase du cycle menstruel. Il est conseillé d'examiner les glandes mammaires dans la première phase du cycle - le 2-3ème jour après la fin des menstruations. Dans la phase II du cycle, en raison de l'engorgement des glandes, la probabilité d'erreurs de diagnostic est élevée: chez les jeunes femmes, dans les tissus mammaires rugueux, il est presque impossible de palper une petite tumeur ou, au contraire, une lobule mammaire rugueux peut être confondu avec une tumeur, ce qui peut conduire à des procédures de diagnostic inutiles. De plus, la palpation dans la seconde moitié du cycle menstruel peut être très douloureuse et la patiente peut tout simplement ne pas permettre un examen approfondi de ses glandes mammaires.
Pour examiner les glandes mammaires, une femme doit se déshabiller jusqu'à la taille et se tenir face à la source de lumière, après quoi le médecin évalue l'apparence des glandes, en prêtant attention à toutes les manifestations d'asymétrie dans la taille des glandes, leurs contours, la peau couleur, position du mamelon, déformation, réseau veineux. Ensuite, le sujet doit lever les mains et les glandes sont à nouveau examinées dans cette position. Après examen, la palpation des glandes mammaires est effectuée, d'abord en position debout de la patiente, puis allongée sur le dos, car l'image de palpation en FCD dans la position allongée et debout de la patiente est fondamentalement différente. Le conglomérat, palpable en position debout, s'effrite en petits nodules et brins lors du changement de position, et vice versa, des phoques indistinctement palpables dans le tissu glandulaire en position debout, lors du changement de position, deviennent plus distincts et accessibles pour l'évaluation.
Ainsi, deux conditions sont extrêmement importantes pour le diagnostic de FCD des glandes mammaires chez les femmes en âge de procréer.
1. Inspection et palpation des glandes mammaires uniquement dans la première moitié du cycle menstruel.
2. Palpation des glandes mammaires dans deux positions du patient - debout et couché.
La palpation est effectuée séquentiellement dans tous les quadrants de la glande mammaire et dans la zone mamelon-aréolaire. Les techniques de palpation peuvent être différentes (radiale, spirale, glissade), cependant ce n'est pas la technique en elle-même qui est importante, mais la minutie de sa mise en œuvre et la couverture de l'ensemble de la glande mammaire. Avec les grosses glandes, il est conseillé de les palper à deux mains, lorsque l'une des mains de l'examinateur est placée sous la glande, et la seconde palpe par le haut, comme entre deux mains. Lors de la palpation des glandes mammaires, l'attention est portée sur leur consistance, la présence ou l'absence de brins, de phoques, de formations volumétriques, leur taille, leur nature de surface, leur densité, leur mobilité, leur adhérence à la peau, etc. sont évalués.
Assurez-vous de palper les ganglions lymphatiques axillaires, sous-claviers et supraclaviculaires, tandis que les ganglions axillaires sont plus accessibles à la palpation lorsque le patient est debout face au médecin, les ganglions sous-claviers sont en décubitus dorsal et les ganglions supraclaviculaires lorsque le patient est assis et le médecin se tient derrière.
La mammographie aux rayons X est la principale méthode d'évaluation objective de l'état des glandes mammaires. Cette technique d'examen aux rayons X permet de reconnaître rapidement les modifications pathologiques des glandes mammaires dans 95 à 97% des cas, d'évaluer le degré de prévalence du processus, de déterminer la nature de la croissance tumorale, l'état de la deuxième glande mammaire, qui est important pour le choix des tactiques de traitement. C'est cette qualité, contrairement à d'autres méthodes de diagnostic, qui nous permet de considérer la mammographie comme le "gold standard" - la principale méthode de dépistage.
Ce qui précède nécessite l'utilisation de méthodes de diagnostic supplémentaires: échographie (échographie), tomodensitométrie à rayons X (RCT), imagerie par résonance magnétique (IRM).
La mammographie est réalisée en deux projections (directe et latérale) du 7e au 10e jour du cycle menstruel sur des appareils spéciaux utilisant des écrans renforçateurs qui permettent de réaliser l'étude dans des conditions d'exposition minimale aux rayonnements. L'examen radiographique permet d'identifier les macrocalcifications, caractéristiques des remaniements kystiques et de l'expansion des conduits, et les microcalcifications.
Les indications
Échographie. L'échographie complète et affine l'image du processus pathologique obtenue avec d'autres méthodes de recherche. Cette méthode permet de reconnaître les formations nodulaires (en particulier les kystes) avec une grande précision, d'évaluer les changements diffus, a un haut débit. Cependant, l'efficacité diagnostique dans la détermination de la tumeur inférieure à 1 cm est de 58%, les formations non palpables - 80%.
DANS dernières années L'échographie Doppler est largement utilisée, ce qui vous permet d'obtenir un affichage couleur du flux sanguin.
La tomodensitométrie aux rayons X est inférieure à la mammographie dans la détection des formes précliniques de cancer dont la taille ne dépasse pas 1 cm de diamètre. Compte tenu de la pénibilité, du coût élevé, de la forte exposition aux rayonnements, du manque d'appareils dans les soins de santé pratiques, la méthode de tomodensitométrie par rayons X est limitée dans son utilisation pour le diagnostic primaire des maladies du sein.
Imagerie par résonance magnétique. Ces dernières années, la possibilité d'utiliser l'IRM dans le diagnostic du cancer du sein a été étudiée.
Les avantages de cette méthode sont la haute résolution et le contraste de l'affichage des éléments de tissus mous, le caractère non invasif et la possibilité d'obtenir une image dans n'importe quel plan arbitraire sans mouvements mécaniques. Le rôle de l'amélioration du contraste est discuté afin d'augmenter le contenu informationnel de la méthode.
La justification de l'utilisation de l'amélioration du contraste est la néovascularisation d'une tumeur maligne d'un diamètre supérieur à 2 mm, mais une proportion importante de ces tumeurs sont avasculaires. La sensibilité de l'IRM avec contraste dynamique dans le diagnostic du cancer du sein est de 95,5 %, la spécificité est de 73,5 %.
Le coût élevé de l'étude rend opportun son utilisation dans des cas diagnostiques complexes, en particulier s'il est nécessaire de différencier les modifications cicatricielles grossières d'un processus malin.
L'expérience de l'utilisation de l'IRM montre que le problème du diagnostic différentiel des modifications bénignes de la glande mammaire demeure, car il est à noter que la haute sensibilité de la méthode est associée à la faible spécificité et précision de l'IRM pour la détection du cancer du sein. De plus, comme dans le cas de la tomodensitométrie à rayons X, cette méthode présente le problème d'équilibrer les possibilités de la méthode et le coût de son application.
Méthodes de diagnostic supplémentaires
Biopsie à l'aiguille. Si une formation nodulaire ou une zone suspecte est détectée, il est nécessaire de la ponctionner, suivie d'un examen cytologique du matériel obtenu. La ponction des formations nodulaires est réalisée comme suit: le patient est placé sur une table ou un canapé; la peau au-dessus du site de ponction est lubrifiée avec un antiseptique.
La formation est fixée avec les doigts et percée avec une aiguille sèche, mise sur une seringue sèche de 10 ml (de manière optimale jetable). En déplaçant à plusieurs reprises le piston, le matériau cellulaire est aspiré dans le canal de l'aiguille. Ensuite, l'aiguille est retirée et le contenu de son canal est soufflé sur une lame de verre propre et dégraissée. Avec une aiguille, la matière est fine
étalé sur la surface d'une lame de verre. En quelques minutes, le matériel est séché et envoyé au laboratoire de cytologie sans aucune fixation. En fonction des résultats d'une étude cytologique, la question de la tactique de traitement est tranchée dans chaque cas.
Ainsi, chacune des méthodes ci-dessus a ses propres capacités et limites, qui déterminent les indications de leur utilisation et leur place dans le diagnostic complexe des maladies.
Réalisé principalement avec un cancer du sein. De plus, il faut exclure les tumeurs bénignes du sein (adénome intracanalaire, fibroadénome) et les lésions de type tumoral (ectasie canalaire, pseudotumeurs inflammatoires, hamartome).
Il est nécessaire, si possible, de rechercher les causes des troubles dyshormonaux, en impliquant les spécialistes concernés (gynécologues, endocrinologues et autres), car sans éliminer ces causes, il est difficile de compter sur le succès du traitement du DMDM. Dans les maladies inflammatoires de la région génitale féminine, du foie, des voies biliaires, de l'hypothyroïdie, le traitement doit commencer par l'élimination de cette pathologie.
Mastopathie fibrokystique (FCM).
Le traitement des maladies dysplasiques bénignes des glandes mammaires doit être effectué en tenant compte de:
Les tactiques thérapeutiques des patients atteints de DMDM sont présentées dans le tableau. 30-3.
Tableau 30-3. Tactiques thérapeutiques chez les patients atteints de DMDM
* Avec l'inefficacité de la thérapie conservatrice - traitement chirurgical (résection sectorielle avec examen histologique urgent).
** Lors du remplissage du kyste - traitement chirurgical (résection sectorielle avec examen histologique urgent).
Dans les formes nodulaires de DMDM, il est d'usage de réaliser des résections sectorielles de la glande mammaire avec examen histologique urgent. Cependant, si aucun signe de prolifération n'a été constaté lors de l'examen cytologique du matériel de ponction (la conclusion du cytologue est qu'il y a peu ou pas de matériel cellulaire, il y a une substance intermédiaire dans la préparation), étant donné que le DMDM n'est pas une tumeur, mais seulement une hyperplasie dyshormonale, c'est-à-dire condition réversible, vous pouvez essayer de commencer le traitement avec une thérapie conservatrice. Souvent, cela réussit: le sceau localisé disparaît complètement ou se décompose en petits fragments élastiques mous.
Si lors de l'examen cytologique du ponctué, des signes de prolifération cellulaire sont constatés, la résection sectorielle de la glande mammaire avec un examen histologique urgent est définitivement indiquée aux patientes. Dans la période suivante, un traitement conservateur est effectué.
Avec des kystes d'un diamètre de 20 mm ou plus, ils sont percés et le contenu est évacué, qui est envoyé pour un examen cytologique. Si des scanners à ultrasons modernes sont disponibles pour évaluer de manière fiable l'état de l'épithélium de la muqueuse du kyste, il n'est pas nécessaire d'effectuer une pneumocystographie. En l'absence de signes de prolifération de l'épithélium de la muqueuse du kyste, un traitement conservateur est prescrit aux patients. Six mois plus tard, une étude de contrôle est réalisée. Dans la grande majorité des cas, les kystes ne se reproduisent pas. Si le kyste est à nouveau rempli, le patient est soumis à une résection sectorielle de la glande mammaire avec examen histologique urgent et poursuite du traitement conservateur.
Dans les cas où le contenu du kyste est visqueux ou mélangé à du sang, quels que soient les résultats de l'examen cytologique, une résection sectorielle de la glande mammaire est réalisée avec un examen histologique urgent. Dans la période suivante, un traitement conservateur est obligatoire. La récidive des kystes, en règle générale, n'est pas notée.
Dans la forme diffuse de la maladie fibrokystique, ainsi qu'en présence de petits kystes (moins de 20 mm de diamètre), dont la ponction est difficile, un traitement conservateur est effectué.
Dans le traitement conservateur de la mastopathie, il n'y a pas d'approche unique, et dans la grande majorité des publications, il n'y a pas de schéma unique pour le traitement complexe de la maladie fibrokystique. Ils ne fournissent qu'une liste de divers médicaments utilisés pour la mastopathie. En raison de la polyétiologie et de la complexité de la pathogenèse des troubles dyshormonaux conduisant au développement du DMDM, la monothérapie est inefficace ou donne un effet temporaire.
Considérant que le DMDM se développe à la suite de troubles dyshormonaux, la tâche principale du traitement conservateur est de normaliser le statut hormonal du patient.
Seules les formes diffuses de mastopathie fibrokystique font l'objet d'un traitement conservateur. Toutes les formes nodulaires font l'objet d'un traitement par des mammologues, car le cancer peut se cacher derrière une tumeur bénigne.
Actuellement, il n'existe pas d'algorithme généralement accepté pour le traitement des formes diffuses de DMDM. Chaque cas nécessite une approche individuelle du médecin. Le choix des médicaments est basé sur la correction de la maladie neuroendocrinienne et gynécologique sous-jacente.
Les préparations hormonales sont à la base du traitement conservateur du DMDM. Les progestatifs, les contraceptifs oraux, les inhibiteurs de la sécrétion de prolactine, les anti-œstrogènes, les agonistes de la GnRH sont utilisés comme agents d'hormonothérapie.
Dans le traitement du DMDM, un rôle important est également joué par :
Tous les patients ayant un diagnostic de DMDM doivent subir un examen annuel par un mammologue avec des procédures de diagnostic (échographie ou mammographie), être observés par un endocrinologue gynécologue (si des troubles dyshormonaux sont détectés).
Il existe une forte relation entre l'utilisation de méthylxanthines (caféine, théophylline, théobromine) et le développement de la mastopathie fibrokystique. Ces composés contribuent au développement du tissu fibreux et à la formation de liquide dans les kystes. Par conséquent, la restriction des produits contenant des méthylxanthines (café, thé, chocolat, cacao, cola), ou leur rejet complet réduira considérablement la douleur, une sensation de tension dans les glandes mammaires.
Favorable.
BIBLIOGRAPHIE
Burdina L.M. Diagnostic et traitement des modifications pathologiques bénignes des glandes mammaires / L.M. Bourdina //
Archives thérapeutiques. - 1998. - T. 70, n° 10. - S. 37–41.
Maladies bénignes des glandes mammaires / E.N. Andreeva, E.V. Ledneva, T.V. Ovsyannikova et al // Conférences cliniques basées sur le matériel de l'école "Aspects modernes de la pathogenèse, du diagnostic et du traitement des maladies des glandes mammaires". - M., 2006. - 83 p.
KampovaPolevaya E.B. Mammologie clinique. État actuel problèmes / E.B. Kampova Polevaya, S.S. Chistyakov. - M. : GEOTARMEDIA, 2006. - 511 p.
Korzhenkova G.P. Diagnostic échographique complexe aux rayons X des maladies du sein: Atlas. - M., 2004.
Koulakov V.I. Gynécologie pratique : (Conférences cliniques) / V.I. Koulakov, V.N. Prilepskaïa. - M. : MEDpressinform, 2006. - 735 p.
V.P. Letyagin Mastopathie / V.P. Letyagin // miel russe. magazine - 2000. - N° 11. - S. 468–472.
V.P. Letyagin Tumeurs de la glande mammaire / V.P. Létiaguine. - M., 2000.
Allred D.C. Évolution histologique et biologique de la maladie prémaligne du sein humaine / D.C. Allred, S.K. Mohsin, S.A. // Fuqua Endocr. Rel. cancer. - 2001. - Vol. 8, n° 1. - P. 47–61.
Expression cellulaire des récepteurs de l'hormone de croissance et de la prolactine dans les affections mammaires humaines / H.C. Mertani, T. Garcia Caballero, A. Lambert et al. // Cancer. - 1998. - Vol. 79, n° 2. - P. 202–211.
Marie PJ Bases cellulaires et moléculaires de la dysplasie fibreuse / P.J. Marie // Histol. histopathol. - 2001. -Vol. 16, n° 3. - P. 981–988.